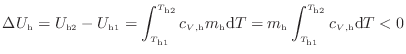 |
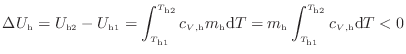 |
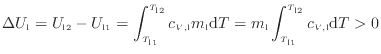 |
仕事の作用がないので伝わった熱![]() [J]と内部エネルギーの変化
[J]と内部エネルギーの変化![]() [J]は式(1.4)
[J]は式(1.4)
![]() に示すように等しく、また高温の物体の内部エネルギーの変化したエネルギーが熱となって伝わり低温の物体の内部エネルギーを上昇させるため、高温の物体と低温の物体の内部エネルギーの変化量の絶対値は等しく次の関係が成り立つ
1.9。
に示すように等しく、また高温の物体の内部エネルギーの変化したエネルギーが熱となって伝わり低温の物体の内部エネルギーを上昇させるため、高温の物体と低温の物体の内部エネルギーの変化量の絶対値は等しく次の関係が成り立つ
1.9。
このように内部エネルギーは系の持っているエネルギーであり、熱は物体間に温度差がある場合ある物体から別の物体へと伝わるエネルギーである。熱の移動は温度の差がある場合だけに起こり、物質や大きさが違えば温度が同じでも内部エネルギーが違うこともありえるが、内部エネルギーの差では熱の移動は起こらない。また温度の低い物体から温度の高い物体へ熱は伝わらないため、熱が伝わる現象は不可逆である。可逆と不可逆の詳細については付録A.1
![]() に示す。
に示す。
これまでに示した温度の変化の際の内部エネルギーの変化を、温度変化として顕(あらわ)れているので顕熱と言う。内部エネルギーには温度変化による顕熱の他に、固相から液相、液相から気相のように相変化をした際の内部エネルギーの変化である潜熱も含まれる。固相から液相、液相から気相への相変化では潜熱により内部エネルギーが増加し、気相から液相、液相から固相への変化では内部エネルギーは減少する。水の加熱を例に挙げると、鍋で水を沸かす場合、常温から水に熱を加えると大気圧かでの水の沸点温度100 ℃まで加えられた熱は顕熱として内部エネルギーが変化し温度が上昇する。温度が100 ℃に到達すると熱を加えても温度は変化せず、加えられた熱により潜熱として内部エネルギーが変化し液相の水が気相の蒸気へと相変化する。水が全て蒸気へと変化すると、鍋の場合には拡散して空気と混ざってしまうが、再度加えられた熱は顕熱として内部エネルギーが変化し、温度が上昇する。水を液相から気相へ相変化させるのに必要な潜熱は大気圧下で単位質量あたりで2257 kJ/kg [#!2008JSTP!#]である。定圧比熱が4.212 kJ/(kg K) [#!2008JSTP!#]であるので、1 kgの水を沸騰させるのに必要なエネルギーで約536 kgの水の温度を1 ℃上げることができる。水1 kgの潜熱に相当する力学的エネルギーは、約2000 kgの物体を重力下で約115 m持ち上げる位置エネルギーで同程度である。