


Next: 2.4 エントロピー
Up: 2.3 ヘルムホルツの自由エネルギー
Previous: 2.3.1 ヘルムホルツの自由エネルギーの定義
可逆過程である準静等温過程における仕事はヘルムホルツの自由エネルギーの差で表されるので、状態1から状態2に変化する準静等温過程での仕事は以下のように表される。
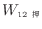 |
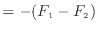 |
(2.1) |
熱力学の第一法則式(1.4) p. ![[*]](crossref.png) は可逆の場合でも成り立つ。
は可逆の場合でも成り立つ。
これより等温準静過程 1→2 における熱は次のように表される。
可逆断熱過程の過程2→3を考えると、熱の受け渡しがないので、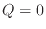 となり以下の式が成り立つ。
となり以下の式が成り立つ。



Next: 2.4 エントロピー
Up: 2.3 ヘルムホルツの自由エネルギー
Previous: 2.3.1 ヘルムホルツの自由エネルギーの定義
この図を含む文章の著作権は著者にあり、クリエイティブ・コモンズ 表示 - 非営利 - 改変禁止 3.0 非移植 ライセンスの下に公開する。
![[*]](crossref.png) は可逆の場合でも成り立つ。
は可逆の場合でも成り立つ。
![]() となり以下の式が成り立つ。
となり以下の式が成り立つ。